充电是充什么?电压电流?
手机充电是不是把电能转化为化学能,这个化学能其实就是电压?
题主这个问题的答案其实很简单:既然电池都是利用氧化还原的原理制作而成的,那么可想而知,电池的充电与放电进程所关联的就是参与反应的化学物质质量了。
我们就以中学化学所学的原电池来讨论吧。
看下图:
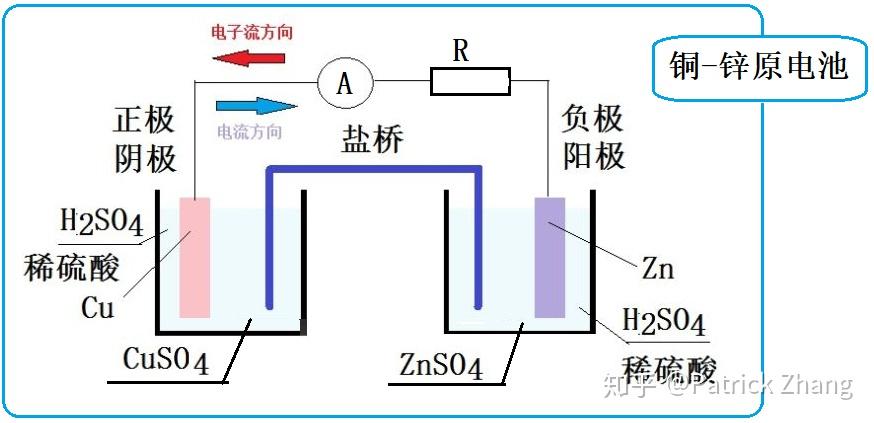
在图1中,我们看到左边容器里插入的是铜棒,右边容器里插入的是锌棒,它们在各自的稀硫酸溶液中形成了硫酸铜和硫酸锌,并离解为 和
电解质。
于是, 之间及
之间就出现了电势差,我们把这种电势差叫做电极电位。见下图:

我们看到,图2中铜的电极电位是0.3419V,锌的电极电位是-0.7618V。两者合并得到电池电动势,E=0.3419-(-0.7618)=1.1037V。
现在,我们用盐桥把图1的两个容器连接起来,再用导线连接了电流表和电阻,我们发现导线中有电流流过。
注意图1中,铜是正极,锌是负极,并且电流方向和电子流方向是相反的:电子流方向是从负极流到正极,而电流方向是从正极流到负极。
在这个过程中,锌不断地被腐蚀掉,它离解为 ,同时提供出2个电子;而铜离子则接收电子,本身被还原。
这就是氧化还原反应。左右两个容器中的半反应表达式见图2。
我们很容易想到,原电池的放电过程其实就是消耗锌的过程,而充电过程其实就是把 还原为元素锌的过程。
题主的问题是:(电池)充电是充什么?电压电流?
回答是:电池充电就是电解质的还原过程,电压和电流的方向见图1。
对于图1,充电其实就是锌离子还原为金属锌。
因为充电时氧化过程还在进行,所以充电电压要高于放电电压。
关于氧化还原反应的详细分析讨论,与主题无关,略去。
首先明确一点,虽然字面意思上充电应该是充的电荷,但实际上,学过物理的人都知道,在电路中,电荷始终是守恒的。不论是供电设备还是耗电设备,本身都不会提供或消耗电荷。
那么所谓充电,实际上是充的什么呢?实际上是电流与电势差的乘积在时间上的积累,A·V·t=W,也就是能量,电荷实际上只是能量的载体。
我们知道,在微观上,无论是电子还是核子,都有能量的概念,在这里也可以简单地理解为势能与动能。在电路中,决大多数电路中,在其工作周期上做累加,电荷的总数是不会改变的,变化的只是电荷的所具有的能量。
对于电池而言,高中化学告诉我们,电池内部实际上只是一系列的可逆化学反应,电子只是作为在此过程中化学能释放/吸收能量的载体,整个反应中,电子(质量)始终是守恒的。
因此,宏观的理解上,充电实际上充的是能量
充电的过程是以电子为载体,将能量输入电池以增加电池内部物质所含有的化学能。
我们知道电池放电其实是物质发生氧化还原反应释放出的能量以电子运动的形式从两极输出以供其他器件工作。
以最常见的铅蓄电池为例:
当其为放电状态时,两极分别发生氧化和还原反应(正极被还原,负极被氧化),负极被氧化,化合价升高,失去电子。正极被还原,化合价降低,得到电子。两边得失电子数目是相当的,那么是什么产生了能量让外部电路工作呢。原因是该反应是自发反应,反应发生导致两极得失电子,在外电路中电子作定向移动,这种电子移动就产生电流驱动电路工作,那么消耗的是什么,是电子移动的动能。假设外电路接了一个白炽灯,那么简单来说就是电子定向移动通过高阻的钨丝发出热辐射,这个过程中,电子的动能损耗而转化为钨丝辐射的热能和光能。但是由于原电池是自发反应,所以两极存在电势差,在这个电势差的电场中,电子会被电场力作用而不断做功,不断提供动能,就像一个人被推着走一样。虽然动能在经过钨丝时发生损耗,但是立即会被补充。所以实际消耗的是势场的势能,这种势能即是原电池的化学能所转化而来。
再看充电过程,将充电源视为一个能稳定提供能量输出的恒流源。其以电流的形式(亦即电子定向移动)将电荷输送到原电池的两极(阴极和阳极),其中阴极(即原电池负极)得到电子,阳极(原电池正极)失去电子,这样在逆向氧化还原反应的作用下,原本放电时得到电子的正极失去电子,放电时被还原的物质被氧化为初始状态,原本放电时失去电子的负极得到电子,放电时被氧化的物质被还原为初始状态。所以就完成了充电过程,也就是说其物质结构和状态变为具有高化学能的初始态。这个过程消耗的是充电源的能量。
对电池来说,电子总量是不变的。
以手机为例,放电过程电池电压在4V左右,负电子从负极流向正极,电子大军一出电池就面临分头行动,有的去了屏幕总成,有的去了CPU,有的去了相机模块,到了这些地方后分头行动但是最终流到了电池正极。
充电过程中充电器接头负极接触电池负极,充电器正极接触电池正极,通过施加一个同向的更高的电压,通常为5V左右,然后一边从电网往电池负极注入电子,一边从正极抽出电子返回电网。另一方面充电器还给出一部分多余电子从负极位置流向手机,保持手机正常运转,经过上述各个元器件后溜到正极附近返回电网。
大体就是这样…
至于为什么要用电池这种化学能来作为载体,就在于这种材料实现起来存电量大,正负极电子差很多时候和很少的时候电压变化不剧烈。可以让电路更好的工作,不用花大把精力去做稳压电源。也许木头,也可以,只是带电量太小,还得需要大电压才能注入一点电子…
然后是关于化学能的事,化学反应本质就是电子,原子,分子的移动重组。反应之前可以说他有化学能,起反应的时候电子移动起来后就叫电能。电子移动趋势大小就是电压…所以本质上是一回事,只是研究角度不同起了不同名字而已!
至于如何实现电流方向控制,电压控制,电量计算这些问题,就是电子电路原理的范畴了!
充电时因为电势差的原因,锂离子从正极迁移到负极,这是将电能转换成了化学能;放电时再从负极迁移到正极,将储存的化学能转化为电能。化学能不是电压,对外表现是电压的变化,实际是活性物质中锂离子的来回迁移。




